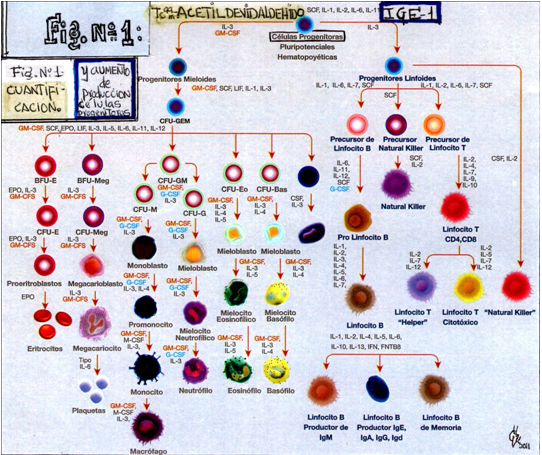
Estructura del átomo
Considere primero las partículas básicas de las cuales toda la materia está compuesta, el PROTON, el NEUTRON y el ELECTRÓN. Existen otras aparte de éstas, pero no son de importancia particular para nosotros en esta discusión. El PROTON, NEUTRON y ELECTRÓN forman la estructura de toda la materia; las otras partículas son difíciles de detectar y algunas tienen una existencia muy corta. Estas constituyen la “maraña” que existe en compañía de nuestras tres partículas básicas.
Veamos estas tres partícula básicas o unidades (lo símbolos mostrados son lo que usaremos en discusiones posteriores):
PROTON Esta es una partícula relativamente pesada con una única carga positiva (+). Fije el nombre y grábeselo en la memoria. “Pro” significa “para” o “con” una dirección positiva.
NEUTRON Esta partícula se asemeja mucho en tamaño y peso a la del protón, sin embargo, esta es neutral, esta no tiene carga eléctrica como su nombre lo indica.
ELECTRÓN Esta es una partícula muy liviana, comparada con el protón o neutrón pesa como 1/1840avo. del peso de estos. Tiene una carga eléctrica negativa (-).
| PROTONES |
NEUTRONES |
Y ELECTRONES |
SE COMBINAN PARA FORMAR ATOMOS
El número de cada una de estas partículas que forman el átomo, determina la clase de átomo que es.
Hay más de 100 diferentes clases de átomos básicos que se conocen, y el número de éstos está aumentando conforme los científicos crean nuevos. Cada uno de estos átomos básicos es identificado como un ELEMENTO y se le da un nombre. Oxígeno, fierro, azufre y plomo son algunos ejemplos comunes de estos elementos básicos.
Elementos o combinaciones químicas de estos elementos (moléculas), forman todas las cosas que vemos en nuestra vida cotidiana. La silla en la que está usted sentado, el techo sobre usted, el aire que lo rodea, están todos hechos de átomos o combinaciones de átomos diferentes o elementos.

Los átomos son pedacitos de materia muy pequeñitos. Hay millones de átomos de carbón en la punta de un lápiz. Esto es un hecho sorprendente cuando se oye por primera vez, pero tal vez más sorprendente es saber que más del 99.99% de un átomo es espacio vacío!. En este momento está usted sentado en menos de 1/100avo de un porciento de lo que usted piensa que está.
Veamos un átomo del elemento helio, un gas muy liviano.
Esta es la forma en que probablemente el átomo se ve: 
Lo examinaremos mostrándolo en esta forma: 
Note que los protones y neutrones están empacados juntos en el centro del átomo. A este grupo de protones y neutrones se le llama el NÚCLEO del átomo.
En el átomo de helio mostrado, hay 2 protones y 2 neutrones en el núcleo. Los neutrones son neutrales no tienen carga eléctrica, pero cada uno de los 2 protones tienen una carga eléctrica positiva, por lo tanto, el núcleo del átomo de helio tiene una carga eléctrica de más 2.
Para que este átomo esté completo, el átomo de helio debe estar eléctricamente neutral, por lo tanto, 2 electrones, cada uno con una carga negativa, orbitan o circundan alrededor del núcleo.
Considerando el tamaño del núcleo y de los electrones, la distancia a la cual los electrones orbitan es muy grande y todo el espacio entre el núcleo y los electrones se encuentra vacío. Esta es la razón de lo afirmado en párrafos anteriores acerca de que el 99.99% de un átomo es de espacio vacío.
Por lo anterior concluimos que todos los átomos completos deben tener un número igual de protones y electrones. Usted entiende el punto que estamos tratando de establecer; que todos los átomos completos deben ser eléctricamente neutrales.
Aquí tenemos más ejemplos de átomos completos (eléctricamente neutrales):

Este es un átomo de berilio.
Cuente el número de
protones ,
neutrones y
electrones .

Este es un átomo de oxígeno.
Cuente el número de
protones ,
neutrones y
electrones .
Analizando estos átomos se hace aparente que aunque el número de electrones debe ser igual al número de protones, el número de neutrones en un átomo puede ser diferente y esto es correcto. Esto nos lleva a nuestro siguiente punto:
El número de protones , en un átomo ( y por lo tanto el número de electrones
, ya que estos son iguales), determina la clase del átomo o elemento. Por ejemplo, todos los átomos que tienen 8 protones son átomos de oxígeno; y todos los átomos que tienen 26 protones son átomos de fierro.
Veamos una lista parcial de los elementos básicos, empezando con el más simple y vea como se relacionan con el número de protones en el núcleo:
Todos los átomos que contienen 1 protón son átomos de hidrógeno.
Todos los átomos que contienen 2 protones son átomos de helio.
Todos los átomos que contienen 3 protones son átomos de litio.
Todos los átomos que contienen 4 protones son átomos de berilio.
Todos los átomos que contienen 26 protones son átomos de fierro.
Todos los átomos que contienen 27 protones son átomos de cobalto.
Todos los átomos que contienen 28 protones son de níquel.
Todos los átomos que contienen 77 protones son átomos de iridio.
Todos los átomos que contienen 78 protones son átomos de platino.
Etc., etc., etc.
La lista de arriba podría ser llenada y alargada, un protón adicional cada vez, hasta más de 100. Y cada número identificará a un elemento básico diferente.
Los elementos básicos, tales como los listados anteriormente, pueden ser identificados o etiquetados en varias formas.
La forma más obvia es usar un nombre, justo como lo hemos estado haciendo hasta ahora. Por ejemplo hidrógeno, helio, cobalto, iridio, etc.
En suma, cada elemento tiene un símbolo o abreviatura que es comúnmente usada en lugar del nombre completo; por ejemplo:
| H es hidrógeno | Co es cobalto |
| He es helio |
Ir es iridio |
Algunas veces los símbolos no se parecen a los nombres, por ejemplo, oro. Su símbolo es Au.
Hay una tercera forma de identificar un elemento básico que debería ser evidente para usted. Ya que cada elemento básico tiene un número específico de protones en cada uno de sus átomos, cualquier elemento puede ser identificado por este número.
Al número de protones en el núcleo de un átomo se le llama NUMERO ATOMICO o NUMERO Z. No hay dos elementos que tengan el mismo número atómico, ya que dos elementos no tienen el mismo número de protones en sus átomos. Veamos a nuestros elementos típicos de nuevo.
| Hidrógeno (H) tiene Z de 1 | Cobalto (Co) tiene Z de 27 |
| Helio (He) tiene Z de 2 |
Iridio (Ir) tiene Z de 77 |
Un átomo que tiene 77 protones, 115 neutrones y 77 electrones tiene un número atómico (Z) de 77. El número de neutrones no tiene nada que ver con el número atómico (Z).
Como materia de interés, el átomo descrito tiene 77 protones, 115 neutrones y 77 electrones es iridio radiactivo, una fuente de radiación comúnmente usada en radiografía.
Continuemos. Mencionamos anteriormente que los protones y neutrones tienen igual tamaño y peso. La única diferencia, hasta donde nos concierne, es que el protón tiene una carga positiva y el neutrón no tiene carga. Dijimos también, que el electrón es mucho más liviano que el protón o neutrón, de hecho su peso es solamente un 1/1840avo. del peso del protón.
Si pudiéramos pesar un átomo, la mayoría de la lectura en la escala sería causada por el núcleo (protones y neutrones). Los electrones y otras partículas incidentales (maraña) son tan livianas que no harían una contribución significante al peso total.

Aquél que acarrea pulgas no
es molestado por el peso de
éstas.
..Antiguo Proverbio Chino
Debido a que los átomos son pedacitos de materia tan extremadamente pequeños, no será lógico tratar de representar su peso en onzas o gramos. En lugar de esto, una unidad de peso más pequeña es usada. La “Unidad de Masa Atómica” o UMA.
Técnicamente, un UMA es 1/12 del peso o masa de un átomo de carbón que tiene 6 protones y 6 neutrones en su núcleo.
Prácticamente, sin embargo, un UMA es casi exactamente igual al peso o masa de un protón o un neutrón.

Ahora tomemos un átomo de iridio radiactivo que ya mencionamos anteriormente. El átomo está formado de 77 protones, 115 neutrones y 77 electrones. Si fuera posible poner este átomo en una báscula sensitiva, su peso en UMA sería de 192. Los electrones siendo tan livianos no aportan mucho al peso de los protones y neutrones.
Como veremos a continuación, todos los átomos del mismo elemento no pesan lo mismo porque puede haber variaciones en el número de neutrones en diferentes átomos del mismo elemento. Por lo tanto, debemos de tener una forma de identificar átomos, no únicamente por el método del numero Z (que representa únicamente el número de protones), sino por algún otro método que tome en cuenta el número variante de neutrones. Esto es realizado asignando a cada tipo de átomo un número que es igual al número total de protones y neutrones en el núcleo.
Ya que este número es el peso aproximado o masa de un átomo en UMA, el número se conoce como el NUMERO MASA O NUMERO “A”.
Por ejemplo, aquí tenemos el átomo de berilio que ya vimos (en la primera y segunda parte.)

El átomo tiene un número Z de 4 porque éste tiene solamente 4 protones. Sin embargo, el número A (masa) para este átomo en particular de berilio es 9, el número total de protones y neutrones.
El número A representa el número total de protones y neutrones en cualquier átomo.
No se preocupe tanto por los UMA’s (Unidades de Masa Atómica). En su trabajo como radiólogo usted verá este término ocasionalmente, pero es de poca importancia, excepto a niveles de ingeniería. Lo usamos aquí meramente para ayudarnos en la definición de MASA o número A.
El uso de las letras Z y A para representar el número atómico y el número masa, respectivamente, es desafortunado porque es confuso en ocasiones. Podría ayudar para diferenciar entre los dos si usted recuerda que “A” no se refiere al “número atómico”, sino a la “masa”. Usted tiene que trasladarse hasta el final del alfabeto para encontrar la designación para el número atómico.
Aquí están las definiciones una vez más:
Z = Número atómico. El número de protones únicamente e el núcleo. Este número determina el tipo de elemento.
A = Número masa. El número de protones y neutrones en el núcleo. Este número identifica átomos diferentes del mismo elemento.
Resumamos todo lo que hemos aprendido en este capítulo referente a partículas atómicas básicas y átomos.
Primero: Los átomos están compuestos de tres partículas básicas: protones, neutrones y electrones. Existen más pero no son de importancia para nosotros.
Segundo: Un protón tiene una sola carga eléctrica positiva, un neutrón no tiene carga eléctrica y un electrón tiene una sola carga eléctrica negativa.
Tercero: Los protones y neutrones están agrupados juntos en el centro del átomo y se les llama núcleo. El electrón orbita a cierta distancia del núcleo.
Cuarto: Un átomo completo debe ser eléctricamente neutro. El número de electrones debe ser igual al número de protones.
Quinto: Todos los átomos de un elemento tienen el mismo número de protones. Cuando el número de protones cambia, es un elemento diferente.
Sexto: Al número de protones se le conoce como “número atómico” o número “Z”.
Séptimo: Al número total de protones y neutrones se le denomina número “masa” o número “A”.
En el capítulo de “Materiales Radiactivos” encontraremos qué pasa cuando el número de neutrones en un átomo cambia, pero el número de protones permanece igual. (Mismo número “Z” pero diferente número “A”).